Природные карбоновые кислоты. Предельные одноосновные карбоновые кислоты
Классификация
а) По основности (т. е. числукарбоксильных групп в молекуле):
Одноосновные (монокарбоновые) RCOOH; например:
СН 3 СН 2 СН 2 СООН;
НООС-СН 2 -СООН пропандиовая (малоновая) кислота

Трехосновные (трикарбоновые) R(COOH) 3 и т. д.
б) По строению углеводородного радикала:
Алифатические
предельные; например: СН 3 СН 2 СООН;
непредельные; например: СН 2 =СНСООН пропеновая(акриловая) кислота

Алициклические, например:

Ароматические, например:

Предельные монокарбоновые кислоты
(одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу C n H 2n+1 COOH (n ≥ 0); или CnH 2n O 2 (n≥1)
Номенклатура
Систематические названия одноосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса - овая и слова кислота.
1. НСООН метановая (муравьиная) кислота
2. СН 3 СООН этановая (уксусная) кислота
3. СН 3 СН 2 СООН пропановая (пропионовая) кислота
Изомерия
Изомерия скелета в углеводородном радикале проявляется, начиная с бутановой кислоты, которая имеет два изомера:

Межклассовая изомерия проявляется, начиная с уксусной кислоты:
CH 3 -COOH уксусная кислота;
H-COO-CH 3 метилформиат (метиловый эфир муравьиной кислоты);
HO-CH 2 -COH гидроксиэтаналь (гидроксиуксусный альдегид);
HO-CHO-CH 2 гидроксиэтиленоксид.
Гомологический ряд
Тривиальное название |
Название по ИЮПАК |
|
Муравьиная кислота |
Метановая кислота |
|
Уксусная кислота |
Этановая кислота |
|
Пропионовая кислота |
Пропановая кислота |
|
Масляная кислота |
Бутановая кислота |
|
Валериановая кислота |
Пентановая кислота |
|
Капроновая кислота |
Гексановая кислота |
|
Энантовая кислота |
Гептановая кислота |
|
Каприловая кислота |
Октановая кислота |
|
Пеларгоновая кислота |
Нонановая кислота |
|
Каприновая кислота |
Декановая кислота |
|
Ундециловая кислота |
Ундекановая кислота |
|
Пальмитиновая кислота |
Гексадекановая кислота |
|
Стеариновая кислота |
Октадекановая кислота |
Кислотные остатки и кислотные радикалы
Кислотный остаток |
Кислотный радикал (ацил) |
|
НСООН |
НСОО- |
|
СН 3 СООН |
СН 3 СОО- |
|
СН 3 СН 2 СООН |
СН 3 СН 2 СОО- |
|
СН 3 (СН 2) 2 СООН |
СН 3 (СН 2) 2 СОО- |
|
СН 3 (СН 2) 3 СООН |
СН 3 (СН 2) 3 СОО- |
|
СН 3 (СН 2) 4 СООН |
СН 3 (СН 2) 4 СОО- |
Электронное строение молекул карбоновых кислот

Показанное в формуле смещение электронной плотности в сторону карбонильного атома кислорода обусловливает сильную поляризацию связи О-Н, в результате чего облегчается отрыв атома водорода в виде протона - в водных растворах происходит процесс кислотной диссоциации:
RCOOH ↔ RCOO - + Н +
В карбоксилат-ионе (RCOO -) имеет место р, π-сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с р-облаками, образующими π- связь, в результате происходит делокализация π- связи и равномерное распределение отрицательного заряда между двумя атомами кислорода:

В связи с этим для карбоновых кислот, в отличие от альдегидов, не характерны реакции присоединения.
Физические свойства

Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода, что объясняется образованием циклических и линейных ассоциатов между молекулами кислот за счет водородных связей:
Химические свойства
I. Кислотные свойства
Сила кислот уменьшается в ряду:
НСООН → СН 3 СООН → C 2 H 6 COOH → ...
1. Реакции нейтрализации
СН 3 СООН + КОН → СН 3 СООК + н 2 O
2. Реакции с основными оксидами
2HCOOH + СаО → (НСОО) 2 Са + Н 2 O
3. Реакции с металлами
2СН 3 СН 2 СООН + 2Na → 2СН 3 СН 2 COONa + H 2
4. Реакции с солями более слабых кислот (в т. ч. с карбонатами и гидрокарбонатами)
2СН 3 СООН + Na 2 CO 3 → 2CH 3 COONa + CO 2 + Н 2 O
2НСООН + Mg(HCO 3) 2 → (НСОО) 2 Мg + 2СO 2 + 2Н 2 O
(НСООН + НСО 3 - → НСОО - + СO2 +Н2O)
5. Реакции с аммиаком
СН 3 СООН + NH 3 → CH 3 COONH 4
II. Замещение группы -ОН
1. Взаимодействие со спиртами (реакции этерификации)

2. Взаимодействие с NH 3 при нагревании (образуются амиды кислот)

Амиды кислот  гидролизуются с образованием кислот:
гидролизуются с образованием кислот:

или их солей:

3. Образование галогенангидридов
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты - PCl 3 , PCl 5 , тионилхлорид SOCl 2 .

4. Образование ангидридов кислот (межмолекулярная дегидратация)

Ангидриды кислот образуются также при взаимодействии хлорангидридов кислот с безводными солями карбоновых кислот; при этом можно получать смешанные ангидриды различных кислот; например:

III. Реакции замещения атомов водорода у α-углеродного атома

Особенности строения и свойств муравьиной кислоты
Строение молекулы

Молекула муравьиной кислоты, в отличие от других карбоновых кислот, содержит в своей структуре альдегидную группу.
Химические свойства
Муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Проявляя свойства альдегида, она легко окисляется до угольной кислоты:
В частности, НСООН окисляется аммиачным раствором Ag 2 O и гидроксидом меди (II) Сu(ОН) 2 , т. е. дает качественные реакции на альдегидную группу:

При нагревании с концентрированной H 2 SO 4 муравьиная кислота разлагается на оксид углерода (II) и воду:

Муравьиная кислота заметно сильнее других алифатических кислот, так как карбоксильная группа в ней связана с атомом водорода, а не с электроно-донорным алкильным радикалом.
Способы получения предельных монокарбоновых кислот
1. Окисление спиртов и альдегидов
Общая схема окисления спиртов и альдегидов:
В качестве окислителей используют KMnO 4 , K 2 Cr 2 O 7 , HNO 3 и другие реагенты.
Например:
5С 2 Н 5 ОН + 4KMnO 4 + 6H 2 S0 4 → 5СН 3 СООН + 2K 2 SO 4 + 4MnSO 4 + 11Н 2 O
2. Гидролиз сложных эфиров

3. Окислительное расщепление двойных и тройных связей в алкенах и в алкинах

Способы получения НСООН (специфические)
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
СO + NaOH → HCOONa формиат натрия
2HCOONa + H 2 SO 4 → 2НСООН + Na 2 SO 4
2. Декарбоксилирование щавелевой кислоты

Способы получения СН 3 СООН (специфические)
1. Каталитическое окисление бутана

2. Синтез из ацетилена

3. Каталитическое карбонилирование метанола

4. Уксуснокислое брожение этанола
Так получают пищевую уксусную кислоту.
Получение высших карбоновых кислот
Гидролиз природных жиров

Непредельные монокарбоновые кислоты
Важнейшие представители
Общая формула алкеновых кислот: C n H 2n-1 COOH (n ≥ 2)
CH 2 =CH-COOH пропеновая (акриловая) кислота

Высшие непредельные кислоты
Радикалы этих кислот входят в состав растительных масел.
C 17 H 33 COOH - олеиновая кислота, или цис -октадиен-9-овая кислота

Транс -изомер олеиновой кислоты называется элаидиновой кислотой.
C 17 H 31 COOH - линолевая кислота, или цис, цис -октадиен-9,12-овая кислота

C 17 H 29 COOH - линоленовая кислота, или цис, цис, цис -октадекатриен-9,12,15-овая кислота
Кроме общих свойств карбоновых кислот, для непредельных кислот характерны реакции присоединения по кратным связям в углеводородном радикале. Так, непредельные кислоты, как и алкены, гидрируются и обесцвечивают бромную воду, например:

Отдельные представители дикарбоновых кислот
Предельные дикарбоновые кислоты HOOC-R-COOH
HOOC-CH 2 -COOH пропандиовая (малоновая) кислота, (соли и эфиры - малонаты)
HOOC-(CH 2) 2 -COOH бутадиовая (янтарная) кислота, (соли и эфиры - сукцинаты)
HOOC-(CH 2) 3 -COOH пентадиовая (глутаровая) кислота, (соли и эфиры - глутораты)
HOOC-(CH 2) 4 -COOH гексадиовая (адипиновая) кислота, (соли и эфиры - адипинаты)
Особенности химических свойств
Дикарбоновые кислоты во многом сходны с монокарбоновыми, однако являются более сильными. Например, щавелевая кислотасильнее уксусной почти в 200 раз.
Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей - кислые и средние:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
При нагревании щавелевая и малоновая кислоты легко декарбоксилируются:

Физические свойства предельных одноосновных кислот
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда - вязкие, «маслообразные» жидкости; начиная с С 10 - твердые вещества.
Простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH 3 COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
Простейшая ароматическая кислота — бензойная C 6 H 5 COOH (т. пл. 122,4°С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C =O и гидроксил —OH , взаимно влияющие друг на друга:
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные , т.е. соединения, полученные в результате реакций по карбоксильной группе.
Названия солей составляют из названий остатка RCOO – (карбоксилат-иона) и металла. Например, CH 3 COONa – ацетат натрия, (HCOO) 2 Ca – формиат кальция, C 17 H 35 COOK – стеарат калия и т.п.
I . Общие с другими кислотами
1. Диссоциация:
R —COOH ↔ RCOO — + H +
-Сила кислот уменьшается в ряду:
H-COOH > CH 3 -COOH > CH 3 -CH 2 -COOH
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H 2
3. Взаимодействие с основными оксидами и основаниями:
2R-COOH + CaO → (R-COO) 2 Ca + H 2 O
R-COOH + NaOH → R-COONa + H 2 O
4. Взаимодействие с солями слабых кислот:
R-COOH + NaHCO 3 → R-COONa + H 2 O + CO 2
Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + H С l → NaCl + R-COOH
В водных растворах гидролизуются:
R — COONa + H 2 O ↔ R — COOH + NaOH
5. Образование сложных эфиров со спиртами:
II . Специфические свойства
1. Образование функциональных производных R — CO — X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl 5 → R-CO-Cl + POCl 3 + HCl
2 . Образование амидов
CH 3 COOH + NH 3 →CH 3 COONH 4 t˚C → CH 3 CONH 2 + H 2 O
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):
4. Особенности муравьиной кислоты H — COOH :
· Даёт реакцию «Серебряного зеркала»:
H-COOH + 2OH → 2Ag↓ + (NH 4) 2 CO 3 + 2NH 3 + H 2 O
· Окисление хлором:
H-COOH + Cl 2 → CO 2 + 2HCl
· Вступает в реакцию с гидроксидом меди(II ):
Химические соединения, которые состоят в том числе и из карбоксильной группы COOH, получили от ученых название карбоновые кислоты. Существует большое количество наименований этих соединений. Они классифицируются по разным параметрам, например, по количеству функциональных групп, наличию ароматического кольца и так далее.
Строение карбоновых кислот
Как уже упоминалось, для того чтобы кислота была карбоновой, она должна иметь карбоксильную группу, которая, в свою очередь, имеет две функциональные части: гидроксил и карбонил. Их взаимодействие обеспечивается ее функциональным сочетанием одного атома углерода с двумя кислородными. Химические свойства карбоновых кислот зависят от того, какое строение имеет эта группа.
За счет карбоксильной группы эти органические соединения можно называть кислотами. Их свойства обуславливаются повышенной способностью иона водорода H+ притягиваться к кислороду, дополнительно поляризуя связь O-H. Также благодаря этому свойству органические кислоты способны диссоциировать в водных растворах. Способность к растворению уменьшается обратно пропорционально росту молекулярной массы кислоты.
Разновидности карбоновых кислот
Химики выделяют несколько групп органических кислот.
Моноосновные карбоновые кислоты состоят из углеродного скелета и только одной функциональной карбоксильной группы. Каждый школьник знает химические свойства карбоновых кислот. 10 класс учебной программы по химии включает в себя непосредственно изучение свойств одноосновных кислот. Двухосновные и многоосновные кислоты имеют в своей структуре две и более карбоксильных групп соответственно.

Также по наличию или отсутствию двойных и тройных связей в молекуле бывают ненасыщенные и насыщенные карбоновые кислоты. Химические свойства и их отличия будут рассмотрены ниже.
Если органическая кислота имеет в составе радикала замещенный атом, то в ее название включается наименование группы-заместителя. Так, если атом водорода замещен галогеном, то в названии кислоты будет присутствовать наименование галогена. Такие же изменения претерпит наименование, если произойдет замещение на альдегидную, гидроксильную или аминогруппы.
Изомерия органических карбоновых кислот
В основе получения мыла лежит реакция синтеза сложных эфиров вышеперечисленных кислот с калиевой или натриевой солью.
Способы получения карбоновых кислот
Способов и методов получения кислот с группой COOH существует множество, но наиболее часто применяются следующие:
- Выделение из природных веществ (жиров и прочего).
- Окисление моноспиртов или соединений с COH-группой (альдегидов): ROH (RCOH) [O] R-COOH.
- Гидролиз тригалогеналканов в щелочи с промежуточным получением моноспирта: RCl3 +NaOH=(ROH+3NaCl)=RCOOH+H2O.
- Омыление или гидролиз эфиров кислоты и спирта (сложных эфиров): R−COOR"+NaOH=(R−COONa+R"OH)=R−COOH+NaCl.
- Окисление алканов перманганатом (жесткое окисление): R=CH2 [O], (KMnO4) RCOOH.
Значение карбоновых кислот для человека и промышленности

Химические свойства карбоновых кислот имеют большое значение для жизнедеятельности человека. Они чрезвычайно необходимы для организма, так как в большом количестве содержатся в каждой клетке. Метаболизм жиров, белков и углеводов всегда проходит через стадию, на которой получается та или иная карбоновая кислота.
Кроме того, карбоновые кислоты используют при создании лекарственных препаратов. Ни одна фармацевтическая промышленность не может существовать без применения на деле свойств органических кислот.

Немаловажную роль соединения с карбоксильной группой играют и в косметической промышленности. Синтез жира для последующего изготовления мыла, моющих средств и бытовой химии основан на реакции этерификации с карбоновой кислотой.
Химические свойства карбоновых кислот находят отражение в жизнедеятельности человека. Они имеют большое значение для человеческого организма, так как в большом количестве содержатся в каждой клетке. Метаболизм жиров, белков и углеводов всегда проходит через стадию, на которой получается та или иная карбоновая кислота.
Карбоновые кислоты.
Строение карбоновых кислот
Карбоновые кислоты - это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН .
Является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:

Свойства карбоновых кислот.
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная .
Карбоновые кислоты со спиртами образуют сложные эфиры . Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира.
Классификация карбоновых кислот.
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты.
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты , рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.

Низшие, средние и высшие карбоновые кислоты.
По числу атомов углерода в молекуле карбоновые кислоты делят на:
Низшие (С1-С3 ),
Средние (С4-С8 ) и
Высшие (С9-С26 ).
Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты. Таким образом, термины «жирные кислоты » и «карбоновые кислоты » часто используются как синонимы .
Предельные и непредельные карбоновые кислоты.
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26 ).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.

Примеры предельных высших жирных кислот:
- Каприновая кислота - C 9 H 19 COOH ,
- Лауриновая кислота - С 11 Н 23 СООН ,
- Миристиновая кислота - С 13 Н 27 СООН ,
- С 15 Н 31 СООН ,
- Стеариновая кислота – С 17 Н 35 СООН .
Примеры непредельных высших жирных кислот:
- С 17 Н 33 СООН
– имеет одну двойную связь,
- Линолевая кислота – С 17 Н 31 СООН - имеет две двойных связи,
- Линоленовая кислота – С 17 Н 29 СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:

В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой.
В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С ) и водорода(Н ) не изображаются.
Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
Натриевые и калиевые соли высших жирных кислот называют мылами .
Например:
C 17 H 35 COONa – стеарат натрия,
С – пальмитат калия.
Натриевые мыла – твёрдые, калиевые – жидкие.
Примеры карбоновых кислот

– жилкость с острым раздражающим запахом.
Температура кипения 118,5 градусов С, при +16,6 градусах С застывает в кристаллическую массу, похожую на лёд.
Смешивается с водой в любых соотношениях.
Широко применяется как прправа к пище и консервирующее средство. В продаже встречается в виде уксусной эссенции (80%) и уксуса (9,3%).
Натуральный или винный уксус – продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина.
Используется также при синтезе многих органических веществ и в качестве растворителя.
Уксусную кислоту получают преимущественно синтезом из ацетилена – присоединением к нему воды и окислением образующегося уксусного альдегида.
Бензойная кислота простейшая одноосновная кислота ароматического ряда. Формула С 6 Н 5 -СООН .

На вид – бесцветные кристаллы.
– антисептик. Применяется для консервирования пищевых продуктови во многих органических синтезах.
– простейшая двухосновная карбоновая кислота.
Формула НООС-СООН.

– кристаллическое вещество, растворяется в воде, ядовита.
В виде кислой калиевой соли содержится во многих растениях.
Применяется для крашения тканей.
Терефталевая кислота НООС-С 6 Н 4 -СООН
Двухосновная карбоновая кислота ароматического ядра.
Её структурная формула:

Из терефталевой кислоты и этиленгликоля получают синтетическое волокно лавсан.
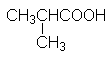
Может служить примером соединения со смешанными функциями – проявляет свойства кислоты и спирта (спиртокислота )

Она образуется при молочнокислом брожении сахаристых веществ, вызываемых особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
– аналог молочной кислоты в ароматическом ряду. Имеет строение:

Относится к соединениям со смешанными функциями – проявляет свойства кислоты и фенола (фенолокислота ).
– антисептик. Её используют (особенно её соли и эфиры) как лекарственное вещество.
Также салициловую кислоту используют при синтезе других продуктов.
Лекция №35
КАРБОНОВЫЕ КИСЛОТЫ
План.
Карбоновые кислоты являются производными углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу.
Карбоновые кислоты можно подразделить на две основные группы:
- Монокарбоновые кислоты (насыщенные, ненасыщенные, аренкарбоновые кислоты).
- Ди- и поликарбоновые кислоты (ненасыщенные, насыщенные, арендикарбоновые и поликарбоновые кислоты).
Монокарбоновые кислоты
Классификация , изомерия и номенклатура
Монокарбоновые кислоты подразделяют в зависимости от природы углеводородного остатка.
a) Насыщенные монокарбоновые кислоты (производные алканов и циклоалканов):
C n H 2n+1 COOH ,
б) Ненасыщенные монокарбоновые кислоты (производные алкинов, алкенов, алкадиенов и других ненасыщенных углеводородов,
C n H 2n-1 COOH , C n H 2n-3 COOH и др .
в ) Аренмонокарбоновые кислоты
ArCOOH, ArCH 2 COOH, ArCH=CHCOOH
Согласно номенклатуре IUPAC название карбоновых кислот образуют от названия родоначальных углеводородов с тем же числом атомов углерода, включая и атом карбоксильной группы, и окончания “–овая кислота”.
Нумерацию начинают от атома углерода
карбоксильной группы. Многие карбоновые кислоты сохраняют тривиальные названия.
Иногда название карбоновой кислоты образуют от названия углеводорода,
содержащего карбоксильную группу в качестве заместителя. Примеры образования
названий в карбоновых кислот приведены ниже
|
Формула |
Тривиальные названия |
Названия в системе IUPAC |
Названия с окончанием “карбоновая кислота” |
|
HCOOH |
Муравьиная кислота |
Метановая кислота |
|
|
CH 3 COOH |
Уксусная кислота |
Этановая кислота |
|
|
CH 3 CH 2 COOH |
Пропионовая кислота |
Пропановая кислота |
|
|
CH 3 CH 2 CH 2 COOH |
Масляная кислота |
Бутановая кислота |
|
|
|
Изомасляная кислота |
2-Метил-пропановая кислота |
|
|
CH 3 CH 2 CH 2 CH 2 COOH |
Валериановая кислота |
Пентановая кислота |
|
|
|
Изовалериановая кислота |
3-метилбу-тановая кислота |
|
|
(CH 3) 3 C-COOH |
Пивалоновая кислота |
2,2-диметил-пропановая кислота |
2-метилпропан-карбоновая-2-кислота |
|
CH 3 (CH 2) 4 COOH |
Капроновая кислота |
Гексановая кислота |
|
|
CH 3 (CH 2) 16 COOH |
Стеариновая кислота |
Октадекановая кислота |
|
|
Циклогексанкарбо-новая кислота |
|||
|
CH 2 =CH-COOH |
Акриловая кислота |
Пропеновая кислота |
Этиленкарбоновая кислота |
|
|
Метакриловая кислота |
2-Метилпропеновая кислота |
Пропенкарбоновая-2 кислота |
|
|
Кротоновая кислота |
транс- Бутен-2-овая кислота |
|
|
|
Изокротоновая кислота |
цис- Бутен-2-овая кислота |
|
|
|
Бензойная кислота |
Бензолкарбоновая кислота |
|
|
|
о-Толуиловая кислота |
o-Толуолкарбоновaя кислота |
|
|
|
Фенилуксусная кислота |
Фенилэтановая кислота |
|
|
|
Коричная кислота |
транс-3 -фенилпропеновая кислота |
Методы получения насыщенных монокарбоновых кислот
1 . Окисление первичных спиртов и альдегидов.
В промышленном масштабе окисление ведут кислородом воздуха при катализе солями марганца или кобальта

В лаборатории окисление осуществляют неорганическими окислителями: KMnO 4 в кислой или нейтральной среде, K 2 Cr 2 O 7 в кислой среде.
2. Окисление неразветвленных алкенов
Окислителями являются K 2 Cr 2 O 7 в кислой среде или KMnO 4 в кислой среде.
3. Окисление алкинов.
В качестве окислителей используют те же реагенты, что и при окислении алкинов.
4.Окисление алканов (промышленный метод)
RCH 2 CH 2 R" + 5/2O 2 ® RCOOH + R"COOH + H 2 O
Окисление осуществляют при катализе реакции солями кобальта или марганца.
5. Гидролитические методы.
а) Кислотный гидролиз нитрилов
RC º N + 2H 2 O + HX ® RCOOH + NH 4 X
б) Основной гидролиз нитрилов
RC º N + H 2 O + NaOH ® RCOONa + NH 3
в) Кислотный гидролиз амидов кислот
г) Основной гидролиз амидов кислот
д) Кислотный гидролиз сложных эфиров
е) Основной гидролиз сложных эфиров
RCOOR" + NaOH ® RCOONa + R"OH
ж) Гидролиз ангидридов карбоновых кислот
(RCO) 2 O + H 2 O ® 2RCOOH
з) Гидролиз галогенангидридов карбоновых кислот
RCOHal + H 2 O ® RCOOH + HHal
и) Гидролиз соединений, содержащих трихлорметильную группу
RCCl 3 + 2H 2 O ® RCOOH + 3HCl
Гидролиз осуществляет либо основанием, либо водой при катализе апротонными кислотами, например, FeCl 3 .
6. Металлоорганический синтез.

7. Реакции карбонилирования

8. Гидрокарбоксилироание галогеналканов и алкенов.

9. Синтез Арндта-Эйстерта
диазокетон
Эта реакция представляет собой удобный способ превращения карбоновой кислоты RCOOH в ее ближайший гомолог RCH 2 COOH.
Технически важную муравьиную и уксусную кислоты получают следующими способами.
Муравьиная кислота и ее эфиры:

Физические свойства и строение
монокарбоновых кислот
Насыщенные монокарбоновые кислоты представляют собой бесцветные жидкие или кристаллические вещества с острым своеобразным запахом, высшие карбоновые кислоты (С 15 – С 18) имеют слабый запах стеарина. Они имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации следствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры.

Электронографическое изучение карбоновых кислот показало, что в их молекуле имеются карбонильная и гидроксильная группа, при этом связь С = О длиннее, чем в кетонах, а связь С – О короче, чем в спиртах. Это свидетельствует о сопряжении неподеленной пары кислорода гидроксильной группы и орбиталей карбонильной группы

Проявляя +М – эффект, атом кислорода гидроксильной группы увеличивает полярность связей ОН, но в то же время в некоторой степени уменьшает положительный заряд на углеродном атоме по сравнению альдегидами и кетонами. Одновременно действует электроноакцепторный индуктивный эффект (-I) кислородных атомов.
Таким образом в карбоксильной группе имеется сильно поляризованный положительно атом водорода гидроксильной группы и углеродный атом которые являются нуклеофильными центрами. В то же время кислородный атом имеет нуклеофильный характер.
Химические свойства карбоновых кислот
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
3.Реакции расщепления
4.Реакции по a -углеродному атому алкильной группы.
Кислотность карбоновых кислот
По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.

Кислотность карбоновых кислот характеризуется константой кислотности К а или показателем рК а. Их значения обычно составляет приблизительно 10 -5 , что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рК а монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рК а b -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы. На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na ® 2RCOONa + H 2
RCOOH + NaOH ® RCOONa + H 2 O
2RCOOH + Na 2 CO 3 ® 2RCOONa + H 2 O + CO 2
Основность карбоновых кислот
В кислой среде (pH<3) диссоциация карбоновых кислот практически не происходит, так как равновесие (1) существенно смещено в левую сторону из-за избытка ионов HSol Å . В то же время в кислой среде осуществляется протонирование карбоновых кислот по основному карбонильному кислороду.
В протонированной форме оба кислородных атомов становятся одинаковыми:

Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот.
Реакции нуклеофильного замещения
1.Реакции этерификации
В механизме этой реакции ключевую роль играет протонирование карбоновой кислоты кислотой-катализатором.

Реакция этерификации может осуществляться некаталитически, однако для этого требуется жесткие условия процесса.
2. Реакции с N-нуклеофилами (аммиаком, аминами, гидразином и др.).
N-нуклеофилы при взаимодействии с карбоновыми кислотами как правило образуют аммониевые соли (карбоксилаты) и только при повышенных температурах происходит присоединение N-нуклеофила к карбонильному углероду.

Механизм реакции согласуется с общепринятыми представлениями о механизме нуклеофильного присоединения азотистых оснований по карбонильной группе:

3. Взаимодействие с галогенангидридами хлорорганических кислот (PCl 3 , PCl 5 , PBr 3 , SOCl 2).

Механизм реакции связан с концертной атакой электрофильного и нуклеофильного центров карбоновой кислоты молекулой галогенангидрида:

Реакции расщепления
1. Синтез Кольбе (см. подробно методы получения алканов).
2. Пиролиз карбоновых кислот.
3. Реакция Хунсдиккера.
RCOOAg + Br 2 ® RBr + CO 2 + AgBr
В качестве объекта декарбоксилирования выступают серебряные или ртутные соли карбоновых кислот, а реагентами являются бром или йод.
Предполагают, что промежуточным продуктом этой реакции является гипогалогенит, который распадается на радикалы:
Эту реакцию можно осуществлять без выделения чистых солей ртути или серебра
2RCOOH + HgO + 2Br 2 ® 2RBr + HgBr 2 + H 2 O + 2CO 2
4. Пиролитическая кетонизация солей карбоновых кислот

Галогенирование по Гелю-Форгальду-Зелинскому
Эта реакция является примером взаимодействия по a -углеродному атому по отношению к карбоксильной группе. Реакция бромирования протекает энергично и с хорошим выходом в присутствии небольших количеств фосфора.
Функция фосфора состоит в образовании трехбромистого фосфора, который, реагируя с кислотой, дает ацилбромид. Последний гораздо легче подвергается енолизации по сравнению с исходной кислотой. Бром по видимому реагирует с енолом ацилбромида так же как с енолами кетонов.
2P + 3Br 2 ® 2PBr 3
RCH 2 COOH + PBr 3 ® RCH 2 COBr + POBr + HBr

Регенерация исходного ацилбромида осуществляется за счет взаимодействия полученного монобромацилбромида с исходной кислотой.
Хлор в присутствии следов фосфора реагирует аналогичным образом, но в целом менее селективно, поскольку конкурентно может происходить свободнорадикальное хлорирование во все положения углеродной цепи.
Взаимодействие с электрофильными реагентами
Атомы кислорода карбонильной группы недостаточно заряжены, чтобы быть объектом электрофильной атаки со стороны слабых и умеренных электрофильных реагентов. Для осуществления эффективной реакции электрофильного замещения по карбонильному углероду карбоксильной группы активируют, переводя ее карбоксилат – ионную форму. Тогда можно осуществить реакцию алкилирование, ацилирования и др.

Реакции восстановления карбоновых кислот
В целом карбоновые кислоты с трудом поддаются восстановлению как путем каталитического гидрирования, так и при действии натрия в спирте, но восстановление до первичных спиртов при действии литийалюминийгидрида или натрийборгидрида протекает достаточно энергично.
4RCOOH + 3LiAlH 4 ® [(RCH 2 O) 4 Al]Li + 4H 2 + 2LiAlO 2
[(RCH 2 O) 4 Al]Li + 3H 2 O + HCl ® RCH 2 OH + Al(OH) 3 + LiCl